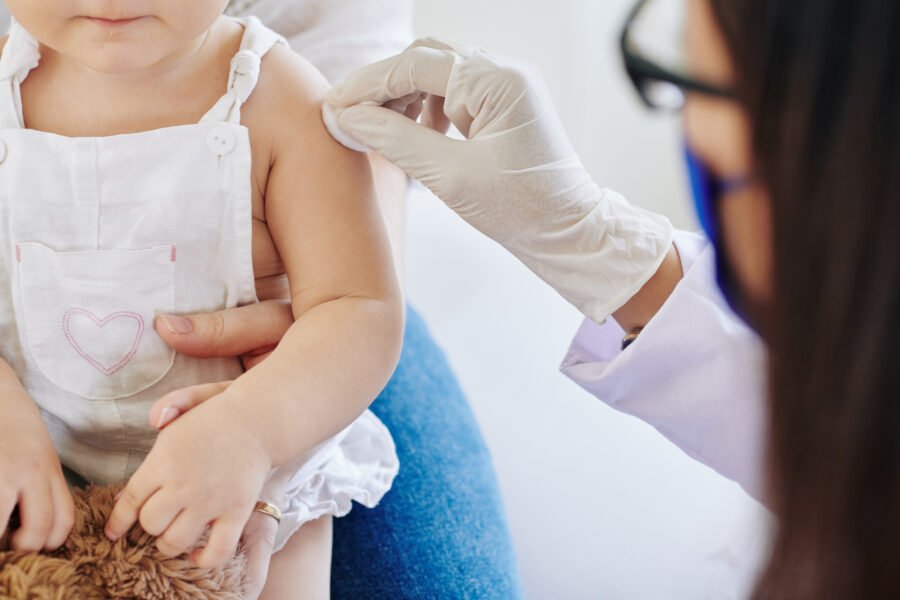
La Administración de Drogas y Alimentos de Estados Unidos (FDA por sus siglas en inglés) autorizó el uso de emergencia de las vacunas contra el coronavirus de Moderna y Pfizer-BioNTech para bebés a partir de los seis meses de vida, según informó el organismo.
Para la vacuna de Moderna, que se dará en dos dosis, la FDA modificó la autorización de uso de emergencia (EUA, por sus siglas en inglés) para incluir su inoculación en población pediátrica de 6 meses a 17 años. Esta vacuna ya había recibido la aprobación definitiva de la FDA el 31 de enero pasado para su aplicación en personas mayores de 18 años.
En tanto, la vacuna de Pfizer-BioNTech, que se dará en tres dosis, recibió la autorización para incluir en el uso de emergencia a personas de 6 meses a 4 años.
Esta vacuna también tiene ya la aprobación definitiva desde el 23 de agosto de 2021 para mayores de 16 años y contaba con una autorización de uso de emergencia para población entre 5 y 15 años.
Además, ambas vacunas tenían ya la autorización de uso de emergencia para ser aplicadas como tercera dosis para completar el esquema primario de personas inmunocomprometidas, y como primer y segundo refuerzo.
«Es una muy buena noticia porque, hasta el momento, no teníamos vacunas disponibles para los bebés a partir de los primeros seis meses de vida, y recordemos que en el grupo que va de los seis meses a los tres años hay chicos y chicas con condiciones de riesgo para hacer formas graves de Covid, que hasta el momento no estaban protegidas», indicó a la médica infectóloga Florencia Cahn.
En el mismo sentido, la patóloga pediátrica Marta Cohen, radicada hace casi 20 años en el Reino Unido, difundió un video celebrando la autorización. «Sabemos que hay chicos sanos que pueden desarrollar síndrome multisistémico inflamatorio que puede ser muy peligroso y aunque sean muy pocos les puede pasar».
Por otro lado, Cohen recordó que «recientemente se ha reunido mucha evidencia sobre que los casos de hepatitis grave aguda en pediatría asociados con adenovirus se dieron en niños que tenían SARS-CoV-2 o lo habían tenido hace poco tiempo».
La vacuna de Pfizer para bebés a partir de los seis meses y niños y niñas, que tiene una concentración de un décimo de la dosis de adultos, se aplicará en tres dosis: la segunda se inoculará tres semanas después de la primera y la tercera dos meses después de la segunda.
En el caso de Moderna, la dosis es un cuarto de la vacuna de los adultos y se inocularán dos dosis con un intervalo de un mes.
En los ensayos clínicos, bebés, niñas y niños que recibieron las vacunas no reportaron efectos secundarios graves.
En relación a los riesgos de estas vacunas en adultos, el comunicado del organismo señaló que «los sistemas de vigilancia de seguridad de la FDA y los CDC identificaron un mayor riesgo de miocarditis (inflamación del músculo cardíaco) y pericarditis (inflamación del tejido que rodea el corazón) después de la vacunación con Moderna y Pfizer-BioNTech particularmente después de la segunda dosis».
«El riesgo observado es más alto en hombres de 18 a 24 años para la vacuna Moderna y en hombres de 12 a 17 años de edad para la vacuna Pfizer-BioNTech», indicaron.
No obstante, aseguraron que «los análisis de los datos de vigilancia» arrojaron que, en «la mayoría de los casos de miocarditis asociados con las vacunas, se caracterizan por una rápida resolución de los síntomas después del tratamiento, sin impacto en la calidad de vida reportada por la mayoría de los pacientes que fueron contactados para seguimiento a los 90 días o más».
Fuente: ámbito.com

